1) Teoria do Octeto
Os átomos tendem a combinar-se de modo a ter, cada um, oito elétrons na sua camada de valência, com exceção do Hidrogênio e o Hélio, que estabilizam-se com dois elétrons, ficando com a mesma configuração eletrônica de um gás nobre. A regra é aplicável aos principais grupos de elementos, especialmente ao carbono, nitrogênio, oxigênio e halogênio, mas também a metais como o sódio ou o magnésio. De forma resumida: as moléculas ou íons tendem a ser mais estáveis quando a camada externa de cada um dos seus átomos está preenchida com oito elétrons.
De fato, parte-se do princípio que, na natureza, todos os sistemas tendem a adquirir a maior estabilidade possível. Os átomos, por exemplo, ligam-se uns aos outros formando moléculas para aumentar a sua estabilidade.
De acordo com esta teoria, existem arranjos menos estáveis que o de um gás nobre que ocorrem regularmente nos metais de transição.
Durante a união dos átomos na formação das moléculas para originar corpos maiores, nada
é mais sensato do que pensar que estes átomos entrarão em contato entre si. Quando
dois átomos entram em contato, o fazem a través das fronteiras das suas eletrosferas, ou seja, de suas últimas camadas. Isso
faz pensar que a última camada de um átomo é a que determina as condições de
formação das ligações químicas.
Quanto a ligação iônica, ocorre com a
formação de íons. A atração entre os átomos
que formam o composto é de origem eletrostática. Sempre um dos átomos perde
elétrons, enquanto o outro recebe. O átomo mais eletronegativo arranca os
elétrons do de menor eletronegatividade. A ligação iônica ocorre entre metais e não-metais e entre metais e hidrogênio.
- átomo com facilidade para liberar os elétrons da última camada: metal
- átomo com facilidade de adicionar elétrons à sua última camada: não-metal
Num
composto iônico, a quantidade de cargas negativas e positivas é
igual. A
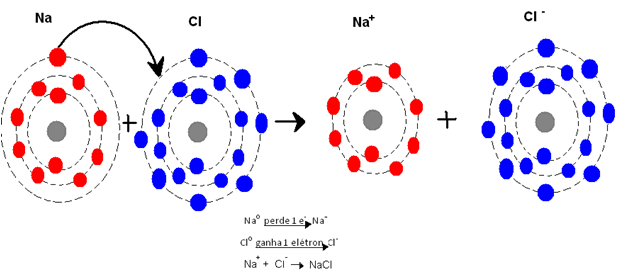
ligação entre o sódio (11Na) e o cloro (17Cl) é um exemplo
característico de ligação iônica. Observe a distribuição dos elétrons em camadas
para os dois elementos:
Para o cloro interessa adicionar um elétron à sua última
camada, completando a quantidade de oito elétrons nela. Ao sódio interessa
perder o elétron de sua camada M, assim a anterior passará a ser a última, já
possuindo a quantidade necessária de elétrons. Na representação da ligação,
utilizamos somente os elétrons da última camada de cada átomo.
O
sódio possuía inicialmente 11 prótons e 11 elétrons. Após a ligação, a
quantidade de prótons não se altera e a de elétrons passa a ser 10. O cloro que
inicialmente possuía 17 prótons e 17 elétrons, tem sua quantidade de elétrons
aumentada de uma unidade após a ligação. Com isso o sódio se torna um íon de
carga 1+ e o cloro 1-. A força que mantém os dois átomos unidos é de atração
elétrica, ou seja, uma ligação muito forte. Como foram utilizados um átomo de
cada tipo, a fórmula do composto será NaCl.
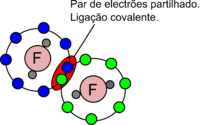
- Ocorre entre não-metal e não-metal
- Entre os átomos ligantes, eles compartilham elétrons respeitando a Teoria do Octeto
Ligações covalentes normalmente ocorrem entre átomos com eletronegatividades similares e altas (geralmente entre dois não-metais), como:
ou também representado por:
4) Ligação Covalente Dativa
O que é uma ligação covalente coordenada ou dativa ? A ligação é covalente coordenada ou dativa, quando o par de elétrons compartilhado é formado por elétrons provenientes de um átomo.
- Ocorre quando um átomo compartilha dois elétrons que provêm do mesmo átomo vizinho.
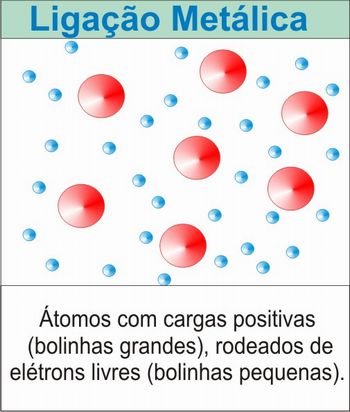
5) Ligação Metálica
Enquanto certos corpos apresentam os elétrons bem presos aos átomos, em outros, algumas dessas partículas permanecem com certa liberdade de se movimentarem no cristal. É o que diferencia, em termos de condutibilidade elétrica, os corpos condutores dos isolantes. Nos corpos condutores, muitos dos elétrons se movimentam livremente no cristal, de forma desordenada, isto é, em todas as direções. E, justamente por ser caótico, esse movimento não resulta em qualquer deslocamento de carga de um lado a outro do cristal.
Os átomos de um metal têm grande tendência a perder elétrons da última camada e transformar-se em cátions. Esses elétrons, entretanto, são simultaneamente atraídos por outros íons, que então o perdem novamente e assim por diante. Por isso, apesar de predominarem íons positivos e elétrons livres, diz-se que os átomos de um metal são eletricamente neutros.
Os átomos mantêm-se no interior da rede não só por implicações geométricas, mas também por apresentarem um tipo peculiar de ligação química, denominada ligação metálica. A união dos átomos que ocupam os “nós” de uma rede cristalina dá-se por meio dos elétrons de valência que compartilham (os situados em camadas eletrônicas não são completamente cheias). A disposição resultante é a de uma malha formada por íons positivos e uma nuvem eletrônica (mar de elétrons).
Click